已知IL-22在促进屏障免疫表面的抗菌免疫(antimicrobial immunity)、炎症和组织修复中起关键作用。IL-22在小鼠模型中可诱导HSC衰老,抑制肝纤维化,加速肝纤维化的恢复。
IL-6是参与炎症通路、造血和免疫调节的多效性细胞因子。IL-6可通过NF-κB信号通路和RAS-MAPK通路降低肝细胞凋亡,促进肝细胞再生。IL-6降低CCl4诱导的急性和慢性肝损伤和纤维化。IL-6预处理可改善肝微环境,使其在间充质干细胞移植中发挥作用,从而改善肝纤维化后的肝损伤。同时,在NAFLD患者中发现IL-6水平升高,IL-6可诱导肝脏胰岛素抵抗和炎症,这表明IL-6可能在NAFLD的病情恶化中起作用。
miRNA与肝硬化
miRNAs是调控许多基因翻译和转录的小的非编码RNA家族,也包括一些其他的转录后调控因子。miRNAs在多种肝病中起关键作用,包括肝炎、肝硬化和肝癌。相关研究表明miRNAs可能同时起到促进抗纤维化作用。
Pro-fibrogenic miRNAmiR-21在肝纤维化的发生发展过程中具有重要作用。miR-21可下调TGF-β的表达并抑制HSC。TGF-β1诱导miR-181a和miR-181b的表达后,通过调节p27和细胞周期而促进HSC增殖。血清中miR181b水平升高是肝硬化患者潜在的诊断生物标志物。
miR214-5p可使LX-2细胞纤维化相关基因(如MMP-2、MMP-9、α-SMA、TGF-β1)表达上调,在肝纤维化的发生、发展中起重要作用。
miR-221和miR-222在肝纤维化中以肝纤维化进展依赖的方式上调,并在小鼠肝纤维化模型中表达显著上调。TGF-α或TNF-α诱导miR-222的表达,其与CDKN1B(p27)3’ UTR结合,从而调控相应蛋白的表达。
在小鼠模型和人的研究中其他纤维化相关miRNA,如miR-19a、miR-19a*、miR-200 a和miR-200 b与肝纤维化的恶化程度呈显著正相关。这些miRNA的表达升高使得HSCs中纤维化相关基因的表达增加。TGF-β对人肝细胞和HSCs中miR-57的上调具有促进作用。
肝硬化和肝纤维化动物模型
动物模型是了解肝纤维化和肝硬化治疗策略的发病机制和发展的关键。到目前为止,已经在小鼠、大鼠、兔和猪中开发了多种类型的动物模型来模拟纤维化和肝硬化的复杂过程。
肝纤维化和肝硬化的动物模型可通过下列途径之一诱导:
(1)由化合物和毒素诱导的纤维化。这些药物对肝细胞造成直接损伤,并在肝脏中引发继发性炎症反应,继而激活HSC并导致纤维化。常用的化学试剂包括CCl4、硫代乙酰胺、二甲基亚硝胺、二恶英、*酸钠、和乙醇。这些药物可以单独或联合一起处理动物;
(2)特殊的饮食,如胆碱缺乏、L-氨基酸定义、蛋氨酸缺乏饮食和高脂肪饮食。当动物单独喂养或与其他化学制剂联合使用时,动物会出现NAFLD和肝硬化;
(3)物理方法。胆管结扎造成肝外胆管梗阻,导致胆汁淤积和随后的胆管上皮细胞和肝细胞损伤,门静脉炎性细胞浸润,纤维组织增生,肝纤维化形成;
(4)纤维化。免疫反应诱导——抗原-抗体复合物可引起Ⅲ型过敏反应。免疫复合物在门静脉周围和中心静脉周围的沉积会引起过敏反应和炎症,刺激造血干细胞分泌胶原和纤维化形成。常见的免疫原包括植物蛋白刀豆球蛋白A和异源血清,如猪、牛、人和血吸虫的血清。据报道,85.5%的大鼠皮下注射人血清白蛋白免疫容易导致肝纤维化和肝硬化。同样,注射蛔虫排泄分泌抗原也成功诱导肝纤维化;
(5)基因修饰。大量研究已经证明在动物中过表达的关键基因和/或沉默抗纤维化基因引起肝硬化。例如,TGF-β1裸质粒DNA的快速静脉注射可诱导小鼠短暂和可逆的肝纤维化。肝特异性缺失的CYLD外显子7/8表现出明显的胆管表型,伴有胆管反应和胆管型纤维化。
肝纤维化和肝硬化治疗
对肝纤维化发生过程的最新进展表明,曾经认为不可逆的肝纤维化和肝硬化实际上有大量论文证实是动态的和可逆的。动物和临床证据证实,任何程度的纤维化甚至肝硬化都可能通过合理的治疗策略可逆。目前,肝纤维化的治疗策略包括以下几个方面:
1 发病因子减弱或消除法去除导致肝纤维化和肝硬化的主要因子(如部分基因和miRNA等)是治疗肝纤维化最直接和最有效的方法。因此,治疗HBV和HCV感染,戒酒,体重和血脂控制等被认为是潜在的有效治疗方法,能够大概率扭转并大大减轻肝纤维化病情恶化概率。常用的抗病毒药物如IFN-α、利巴韦林、拉米夫定、阿德福韦、恩替卡韦,以及聚乙二醇化干扰素-α发挥着巨大的作用。
2 抗炎症抗免疫反应疗法肝内炎症和免疫反应是肝细胞损伤和肝星状细胞被激活的直接原因。尤其是病毒性肝炎、自身免疫性肝炎和原发性硬化性胆管炎引起的纤维化和肝硬化,抑制炎症以及免疫抑制疗法是抑制纤维化的重要措施。抗炎药塞来昔布和抗氧化剂牛磺酸和维生素E均表现出一定程度的抗纤维化作用。同样,糖皮质激素,硫唑嘌呤,秋水仙素和雷帕霉素(162163)似乎发挥抗炎、抗纤维化和免疫调节作用,因此可能在治疗肝纤维化方面是有用的。
3 抑制造血干细胞的活化和促进细胞凋亡HSCs在肝纤维化发生中起重要作用,是抗纤维化治疗的潜在靶细胞。抑制肝星状细胞活化是针对肝纤维化的一种非常有潜力的的明星疗法。通过抑制TGF-β1信号通路和PDGF-B可以实现HSCs的失活,并通过诱导这些细胞发生凋亡而激活活化的造血干细胞。目前已经发现一些细胞因子和生长因子如胰岛素样生长因子-1、IFN-α和IFN-γ能够诱导HSCs凋亡。IκB激酶抑制剂也可促进HSCs凋亡,并发挥抗纤维化作用。其他药物如胶质毒素、柳氮磺胺吡啶、苯二氮卓类配体、姜黄素和丹参酮I等已分别被用于诱导HSC凋亡。
4 保护肝功能促进肝细胞再生肝保护剂水飞蓟素已广泛应用于慢性肝病和肝硬化的治疗。熊去氧胆酸和牛磺熊去氧胆酸对肝细胞器损伤有保护作用,已被证实是治疗原发性硬化性胆管炎的有效药物。钙通道阻滞剂(例如维拉帕米)还通过稳定肝细胞膜和降低门静脉压力来保护肝脏从而起到抗纤维化作用。
肝细胞凋亡是肝损伤的常见事件,从而引起肝硬化的发生和恶化。因此,防止肝细胞发生凋亡,促进肝细胞再生是肝纤维化和肝硬化的有效治疗策略。肝细胞生长因子(HGF)是一种抗纤维化的生长因子,它在HSCs诱导细胞凋亡并刺激肝细胞再生,已被用于治疗肝硬化。注射骨髓来源的细胞和间充质细胞据悉已经作为为治疗肝硬化的一种潜在有效的方法,因为这些细胞可以在肝脏中分化为肝细胞样细胞并刺激肝细胞B的增殖。此外肝细胞生长因子过表达人脐血间充质干细胞对肝纤维化具有良好的治疗作用
5 基因治疗与靶向治疗在肝硬化发病机制中涉及的几个关键基因如TGF-β、PDGF-β、CTGF和TIMP已被作为肝硬化的治疗靶点。反义核苷酸序列(Antisense oligonucleotides)和siRNas针对这些基因已分别进行了体外和体内试验。近年来,miRNA通过调节肝纤维化和纤维化基因的表达,影响肝纤维化的增殖和活化,在肝纤维化和肝硬化的发病机制中发挥了调节作用。因此,基于miRNA的治疗可以潜在地用于治疗肝纤维化。此外,为了更直接地靶向成纤维细胞,已经尝试以靶向造血干细胞上表达的原纤维蛋白的受体作为一种新途径。
6 补充替代医学部分论文显示,一些传统的中草药在治疗肝纤维化和肝硬化方面具有一定疗效,并因此在世界范围内广受欢迎。这些草药包括以下类别:纯化合物(例如丹酚酸B和氧化苦参碱)。粉防己碱、甘草次酸和姜黄素的机制、单剂(如丹参和灵芝)、复合式(如傅正华瑜胶囊、鳖甲煎、易淦康颗粒)。中草药发挥抗纤维化作用尚不清楚,但可能包括抗病毒和抗炎作用,免疫调节,抑制HSC活性,并促进胶原降解。需要进一步的扩大临床试验数量,并应仔细评估可能的副作用。
,前言
肝硬化通常由多种慢性肝病引起的,包括酒精性、慢性丙肝HCV感染、非酒精性脂肪肝NAFLD以及乙肝HBV感染引起的慢性肝病等。肝硬化还有其他多种因素,如遗传病血色素沉淀症、Wilson疾病、原发性胆汁性肝硬化、原发性硬化性胆管炎和自身免疫肝炎。
部分病例具有特发性或隐发性等特点,近几年来NAFLD已经成为美国等西方国家慢性肝病的主要病因。
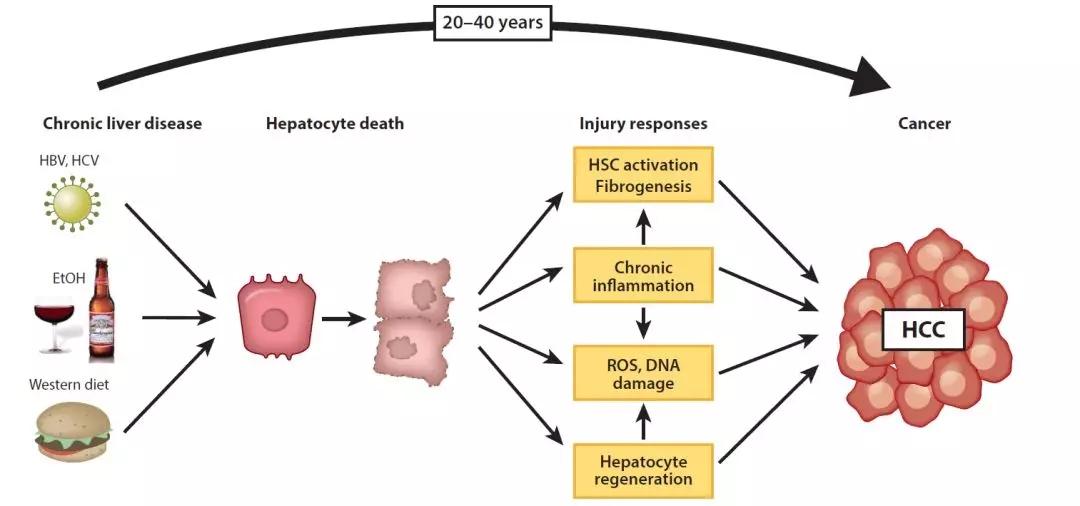
尽管引起肝硬化的病因是多方面的,但也有一些病理特征,如肝硬化干细胞的变性坏死,肝纤维化组织和再生结节的肝实质replacement。
肝硬化的前兆通常是纤维化,是所有慢性肝病演变为肝硬化的关键的病理过程。
目前虽然仍然缺乏肝硬化有效的治疗手段,肝硬化深层的分子机制仍然有待继续挖掘。因此更好地了解肝硬化的发病机制将有助于开发更加有效的治疗方案。
肝硬化发病机制与多种肝脏细胞
Multyple Cell types contribute to pathogenesis of liver cirrhosis
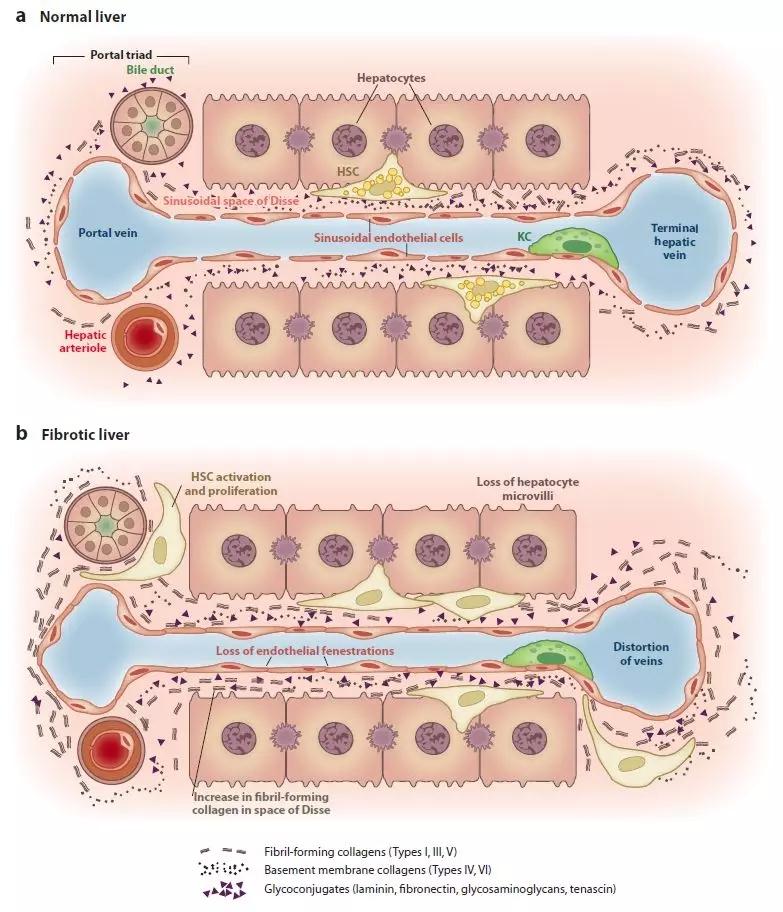
肝脏由肝实质细胞组成(parenchymal cells)如肝细胞hepatocytes以及其他常见的几种非实质细胞(nonparenchymal cells)。肝窦由三种非实质细胞组成:窦内皮细胞LSECs、Kupffer肝巨噬细胞KCs和肝星状细胞HSCs。无论是实质细胞还是非实质细胞都会对肝纤维化和肝硬化有很大的影响。
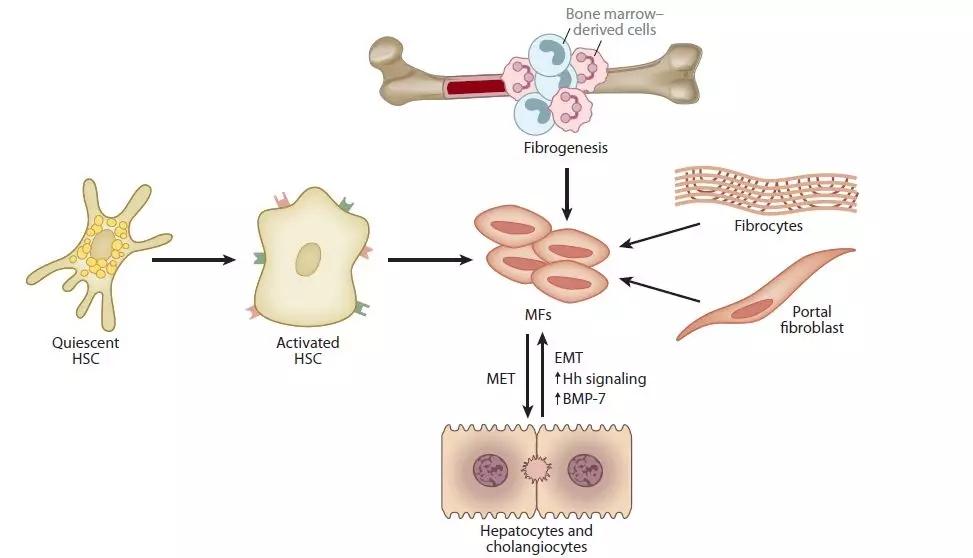
HSCs也叫储脂细胞、ito细胞、脂肪细胞、维A存储细胞、窦周细胞等称呼,主要存在于正常肝脏组织的Disse间隙,紧贴着肝窦内皮细胞和干细胞之间。当其暴露在多种炎症因子如血小板源性生长因子PDGF、转化生长因子TGF-β、肿瘤坏死因子TNF-α、白介素IL1等,HSCs会被激活导致肝纤维化,其中胶原蛋白沉淀是主要因素之一。HSCs被激活后以细胞增殖和迁移、转化成肌成纤维细胞、产生大量胶原和其他细胞外基质(ECM)为特征,最终导致肝纤维化。
2 LSECsLSECs也叫内皮细胞,具有很强的细胞内吞能力。长期滥用酒精会导致LSECs窗孔(fenestrae)数量减少。维生素A缺乏容易引起细胞外基质ECM上调,从而使得HSCs转变成肌成纤维细胞(myofibroblasts),最终导致肝纤维化。肝内皮细胞肝窦毛细血管化对于肝纤维化的发生至关重要,主要由维生素A代谢通路调控。无论是动物模型还是在病人体内都证实LSECs能够分泌细胞因子IL-33去激活HSCs从而引起纤维化。LSECs的肝窦毛细血管化导致底物交换功能受损,并且是肝纤维化功能失调的主要原因。
3 KCsKCs也叫星状巨噬细胞、Kupffer细胞和肝巨噬细胞,主要存在肝窦内壁,是形成内皮系统的一部分。动物模型表明KCs与各种感病的发病机制关联。诸如病毒、酒精、高脂肪饮食等各种有害因素可以激活KCs。被激活的KCs由于感染了病毒过程中产生有害介质并破坏干细胞。KC介导的肝炎被认为会加重肝损伤和肝纤维化。KCs参与HSCs的激活及肝纤维化。
体外实验表明,KCs在有条件培养下可通过诱导PDGF受体在HSCs培养大鼠造血干细胞,增强基质合成和细胞增殖。高脂饮食的大鼠中,KC衍生的TGF-β1能够刺激HSCs的增殖和胶原蛋白沉淀。此外酒精能够诱导革兰氏阴性菌脂多糖LPS的水平,继而激活和诱导KCs。
在遗传性血色素沉着症中,KCs中铁元素过量可诱导肝细胞ICAM-1的表达,从而引起肝组织中HSCs被激活,产生胶原蛋白沉淀。被激活的KCs分泌胶原酶通过对IV型胶原蛋白的降解诱导HSCs表型的改变。KCs吞噬凋亡小体(apoptotic bodies)并产生包括Fas配体和THF-α在内的若干种死亡配体,从而促进炎症和纤维化发生。此外,KCs被β-葡聚糖激活并释放血栓素A2,导致门静脉压力升高。
4 HSCs肝细胞也叫肝实质细胞,在肝纤维化和肝硬化中行使的作用较为复杂。肝细胞是大多数肝毒性药物的靶标,包括肝炎病毒、酒精代谢物和胆汁酸。慢性肝病可促进细胞凋亡或触发肝细胞代偿性再生。受损肝细胞释放活性氧(ROS)和成纤维介质,诱导HSC活化,并刺激肌成纤维细胞的成纤维作用。肝损伤会伴随肝细胞凋亡,引起组织炎症、纤维化和肝硬化。脂肪性肝炎会加剧Fas介导的肝细胞凋亡,并与NF-κB及疾病严重程度相关。丙肝病毒感染和酒精均可以在动物模型和人中诱导肝细胞凋亡,诱导可能与Bcl-2信号的下调有关。慢性丙型肝炎病毒感染可延缓肝细胞G1期,损害肝细胞功能,限制肝再生。在CCl4诱导的肝损伤中,肝细胞凋亡在早期被诱导,随后持续增殖最终导致肝硬化。肝细胞是基质金属蛋白酶(MMP-2、MMP-3和MMP-13)和基质金属蛋白酶组织抑制剂(TIMP-1和TIMP-2)的主要来源,这些均参与了CCl4诱导大鼠肝硬化的发病机制。在最后的纤维化阶段或肝硬化,低氧肝细胞成为TGF-β1的主要来源,进一步加重肝纤维化。近年来,肝硬化患者肝细胞端粒缩短和衰老可导致纤维化瘢痕形成,为肝硬化的病理生理机制提供了新的解释。
细胞因子在肝纤维化和肝硬化的作用
PDGF是HSCs所有多肽生长因子中作用最强的分裂素之一,PDGF家族包括A/B/C/D四种亚型。PDGF及受体蛋白在纤维组织中显著高表达。PDGF随着肝纤维化程度的增加而增加。诸如病毒、化学物质或机械损伤肝细胞可诱导KCs合成并释放PDGF。PDGF与HSCs膜上的特异性受体结合后,激活相应的信号分子和转录因子,导致其下游靶基因的激活和HSCs的活化。PDGF家族能够诱导上调MMP-2、MMP-9和TIMP-1的表达,抑制胶原酶的活性,从而降低ECM降解。PDGF-B和PDGF-D是PDGF受体(PDGFR)β信号在HSCs内的PDGF亚型,如PDGFR-β自身磷酸化和细胞外信号调节激酶(ERK)1/2、c-Jun N-末端激酶(JNK)、p38丝裂原活化蛋白激酶(MAPK)和蛋白激酶的激活所验证的(PK)B/Akt途径。PDGF-D能激活HSCs并发挥有丝分裂和纤维化的作用,因此在肝纤维化的基质重塑中起重要作用。
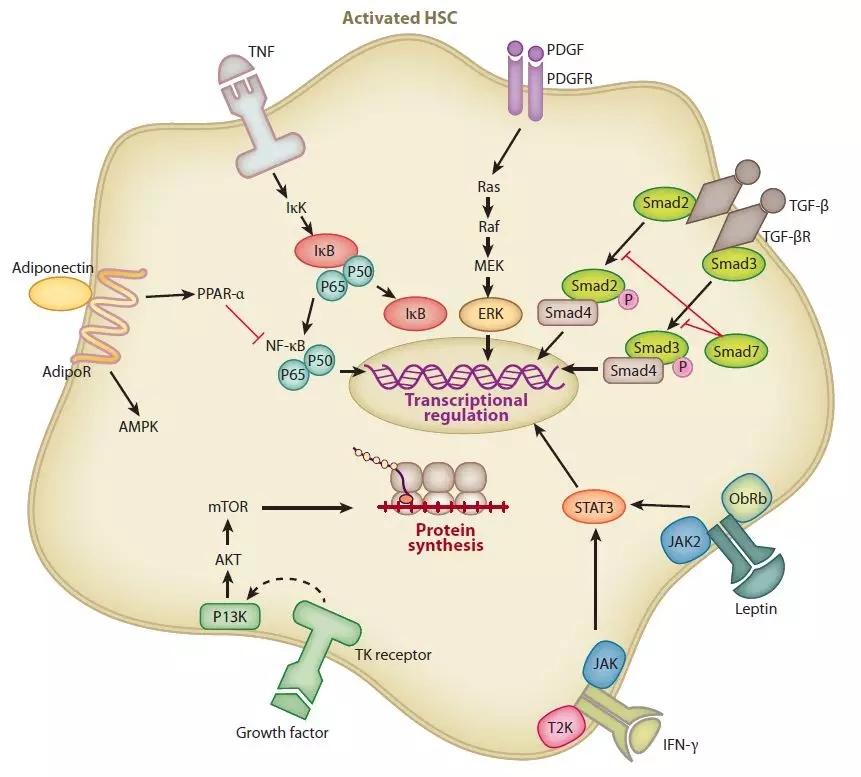
2 转化生长因子β TGF-β
TGF-β是肝纤维化最强诱导因子之一,TGF-β主要是由肝脏干细胞肌成纤维细胞、KCs、LSECs和肝细胞中合成。TGF-β1家族有6个成员组成,其中TGF-β1在肝纤维化的发生和维持中起重要作用。TGF-β1在纤维化肝中的表达增加,在肝硬化时达到最大值。TGF-β1的促纤维化作用机制较为复杂,涉及多种方面:TGF-β1的主要作用是刺激并激活造血干细胞,被激活的HSCs中TGF-β1自分泌环是肝纤维化不断恶化的重要正反馈。TGF-β1通过下调基质金属蛋白酶的表达和促进TIMP的表达,诱导基质生成基因的表达,抑制ECM的降解,导致胶原纤维过度沉积,促进肝纤维化恶化。此外,TGF-β1抑制DNA合成并诱导肝细胞凋亡。TGF-β1诱导的细胞凋亡被认为是肝硬化组织丢失和肝体积减小的原因。鉴于TGF-β1在肝硬化发病中的重要作用,特异性阻断TGF-β1/SMAD3信号通路对肝纤维化具有一定的治疗价值。
3 肿瘤坏死因子TNF-αTNF-α主要由单核细胞、巨噬细胞、造血干细胞和KCs产生。在这些细胞中具有促炎活性和细胞毒作用。在肝纤维化过程中,TNF-α在HSCs活化和ECM[84/85]的合成中起重要作用。TNF-α通过上调抗凋亡因子NF-κB、Bcl-xL和p21WAF1,下调凋亡因子p53(86),可降低活化的大鼠HSC自发性凋亡。然而,TNF-α对HSCs和纤维化的影响是复杂的,甚至是矛盾的,如TNF-α诱导HSCs凋亡的研究所证实的[87 ]。TNF-α还可通过降低谷胱甘肽和抑制前胶原α1的表达而在大鼠HSC中发挥抗纤维化作用〔88〕。在非酒精性脂肪性肝炎(纳什)大鼠模型中,TNF-α抗体可减轻肝脏炎症、坏死和纤维化(89)。纳什激活的TNF-α信号通路在肝纤维化发病机制中的作用。
4 干扰素IFN
地 址: 杭州经济技术开发区下沙6号大街260号中自科技园16幢4层 联系人: 吴先生 电 话: 0571-87662413 传 真: 0571-81951905 Email:market@lc-bio.com
联川生物技术公司
商家主页
